I
Раство́ры
макроскопически однородные смеси двух или большего числа веществ (компонентов), образующие термодинамически равновесные системы. В Р. все компоненты находятся в молекулярно-дисперсном состоянии; они равномерно распределены в виде отдельных атомов, молекул, ионов или в виде групп из сравнительно небольшого числа этих частиц. С термодинамической точки зрения Р. - фазы переменного состава, в которых при данных внешних условиях соотношение компонентов может непрерывно меняться в некоторых пределах. Р. могут быть газообразными, твёрдыми (см.
Твёрдые растворы). Чаще же всего термин "Р." относят к жидким Р.
Практически все жидкости, встречающиеся в природе, представляют собой Р.: морская вода - Р. большого числа неорганических и органических веществ в воде, нефть - Р. многих, как правило органических, компонентов и т.д. Р. широко представлены в технике и повседневной практике человека.
Простейшие составные части Р. (компоненты) обычно могут быть выделены в чистом виде; их смешением можно вновь получить Р. любого допустимого состава. Количественное соотношение компонентов определяется их концентрациями. Обычно основной компонент называют растворителем, а остальные компоненты - растворенными веществами. Если одним из компонентов является жидкость, а другим - газы или твёрдые вещества, то растворителем считают жидкость.
Классификация Р. основана на различных признаках. Так, в зависимости от концентрации растворённого вещества Р. делят на концентрированные и разбавленные; в зависимости от характера растворителя - на водные и неводные (спиртовые, аммиачные и т.п.); в зависимости от концентрации ионов водорода - на кислые, нейтральные и щелочные.
В соответствии с термодинамическими свойствами Р. подразделяют на те или иные классы, прежде всего - на идеальные и неидеальные (называемые также реальными). Идеальными Р. называют такие
растворы, для которых
Химический потенциал μ
i каждого компонента
i имеет простую логарифмическую зависимость от его концентрации (например, от мольной доли
xi):
μ
i =
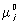
(
p,
T) +
RT ln
xi, (1)
где через обозначен химический потенциал чистого компонента, зависящий только от давления
р и температуры
Т, и где
R - Газовая постоянная. Для идеальных Р. энтальпия смешения компонентов равна нулю, энтропия смешения выражается той же формулой, что и для идеальных газов, а изменение объёма при смешении компонентов равно нулю. Эти три свойства идеального Р. полностью характеризуют его и могут быть взяты в качестве определяющих для идеального Р. Для идеальных Р. выполняются
Рауля законы и
Генри закон. Опыт показывает, что Р. идеален только в том случае, если образующие его компоненты сходны друг с другом прежде всего в отношении геометрической конфигурации и размера молекул. Наиболее близки к идеальным Р. смеси соединений с изотопозамещёнными молекулами.
Как правило, для идеальных Р. соотношение (1) справедливо во всей области изменения концентраций. Концентрации, при которых в данном Р. начинают обнаруживаться заметные отклонения от идеальности, очень сильно зависят от природы образующих его веществ. Большинство достаточно разбавленных Р. ведут себя как идеальные.
Р., не обладающие свойствами идеальных Р., называются неидеальными. Для них выполняется соотношение, аналогичное (1) при замене концентрации на активность: ai = γixi, где ai - активность компонента i, γi - коэффициент активности, зависящий как от концентрации данного компонента, так и от концентраций остальных компонентов, а также от давления и температуры. Среди неидеальных Р. большой класс составляют регулярные Р., которые характеризуются той же энтропией смешения, что и идеальные Р., однако их энтальпия смешения отлична от нуля и пропорциональна логарифмам коэффициентов активности. Особый класс составляют атермальные Р., у которых теплота смешения равна нулю, а коэффициенты активности определяются только энтропийным членом и не зависят от температуры. Теория таких Р. часто позволяет предсказывать свойства неидеальных Р., например в случае неполярных компонентов с сильно различающимися молекулярными объёмами. Близки к атермальным многие Р. высокомолекулярных соединений в обычных растворителях.
При определённых температуре и давлении растворение одного компонента в другом обычно происходит в некоторых пределах изменения концентраций. Р., находящийся в равновесии с одним из чистых компонентов, называемом насыщенным (см.
Насыщенный раствор), а его концентрация -
Растворимостью этого компонента. Графически зависимость растворимости от температуры и давления представляется растворимости диаграммой (См.
Растворимости диаграмма)
. При концентрациях растворённого вещества, меньших его растворимости, Р. является ненасыщенным. Если Р. не содержит центров кристаллизации (См.
Кристаллизация), то его можно переохладить так, что концентрация растворённого вещества окажется выше его растворимости, а Р. становится пересыщенным. Ряд практически важных свойств Р. связан с изменением давления насыщенного пара растворителя над Р. при изменении концентрации растворённого вещества: понижение температуры замерзания (см.
Криоскопия), повышение температуры кипения (см.
Эбулиоскопия) и т.д.
Строение Р. определяется прежде всего характером компонентов, его образующих. Если компоненты близки по химическому строению, размерам молекул и т.п., то строение Р. принципиально не отличается от строения чистых жидкостей. Молекулы веществ, заметно отличающихся по своему строению и свойствам, обычно сильнее взаимодействуют друг с другом, что приводит к образованию комплексов в Р., которые вызывают отклонения от идеальности. Энергии образования этих комплексов достигают величин нескольких
кдж/
моль, что позволяет говорить о существовании в Р. слабых химических взаимодействий и образовании тех или иных химических соединений - новых компонентов Р. Взаимодействие с молекулами растворителя сопровождается у многих веществ (например, электролитов) обратным процессом - диссоциацией (См.
Диссоциация)
. Соли,
Кислоты и основания при растворении в воде и др. полярных растворителях частично или полностью распадаются на ионы, вследствие чего число различных частиц в Р. увеличивается. При электролитической диссоциации суммарная электронейтральность Р. сохраняется; около каждого иона образуется слой более тесно связанных с ним молекул растворителя - сольватная оболочка (см.
Сольватация).
В Р. при очень малых концентрациях растворённого вещества сохраняется структура растворителя. По мере увеличения концентрации возникают новые структуры, например в водных Р. возникают различные структуры кристаллогидратов (См.
Кристаллогидраты)
. Ионы больших размеров разрушают структуру растворителя, в результате чего появляются экспериментально наблюдаемые неоднородности в этой структуре. Специфическими особенностями характеризуются Р. высокомолекулярных соединений (см.
Растворы полимеров).
Молекулярно-статистическая теория Р. развита лишь для простейших классов Р. Так, при рассмотрении Р. неассоциированных жидкостей часто используют представление о Р. как о статистической совокупности твёрдых образований ("сфер", "эллипсоидов", "стержней"), взаимодействующих друг с другом по определённому модельному закону. Для сильно разбавленных Р. электролитов ограничиваются учётом только электростатического взаимодействия ионов как точечных зарядов или как сферических образований определённого радиуса и т.д.
Лит.: Кириллин В. А., Шейндлин А. Е., Термодинамика растворов, М., 1956; Шахпаронов М. И., Введение в молекулярную теорию растворов, М., 1956; Prigogine I., The molecular theory of solutions, Arnst., 1957; Робинсон Р., Стокс Р., Растворы электролитов, пер. в англ., М., 1963; Тагер А. А., Физико-химия полимеров, 2 изд., М., 1968; Курс физической химии, под общ. ред. Я. И. Герасимова, 2 изд., т. 1-2, М., 1969-73.
Н. Ф. Степанов.
II
Раство́ры
строительные, строительные материалы, получаемые в результате затвердевания рационально подобранных смесей вяжущего вещества (с водой, реже без неё) и мелкого заполнителя - растворных смесей. (Нередко термин "Р." неправомерно употребляют в значении "растворная смесь".) В соответствии с назначением Р. их подразделяют на кладочные, применяемые при возведении каменных конструкций (См.
Каменные конструкции) (преимущественно из кирпича, бутового камня), отделочные - для штукатурных работ (См.
Штукатурные работы) и нанесения декоративных слоев на стеновые панели и блоки, специальные (гидроизоляционные, кислотоупорные, акустические, тампонажные и др.). По виду вяжущего вещества (см.
Вяжущие материалы) различают Р. на неорганических вяжущих: цементные, известковые, гипсовые и смешанные (например, известково-цементные) и на органических вяжущих: полимеррастворы (см.
Полимербетон), асфальтовые
растворы (см.
Асфальтобетон) и др.
В зависимости от объёмной массы Р. делят на тяжёлые (на обычном песке) - объёмной массой 1500-2500
кг/
м3 и лёгкие - объёмной массой менее 1500
кг/
л3 (для получения последних используют мелкие пористые
Заполнители, а также поризацию вяжущего теста). По прочности на сжатие Р. подразделяют на 9 марок - от "4" до "300" (4-300
кгс/
см2, или 0,4-30
Мн/
м2).
Наиболее широко применяются кладочные и отделочные Р. на минеральных вяжущих. Общая теория таких Р. впервые была разработана в СССР в 30-х гг. Н. А.
Поповым
. Будучи аналогичными по составу песчаным (мелкозернистым) бетонам (См.
Песчаный бетон), Р. отличаются от последних повышенной пластичностью растворной смеси и, обычно, меньшей прочностью, что обусловливает специфику их применения - преимущественно в виде тонких слоев, получаемых укладкой растворной смеси на пористое основание (кирпич, дерево и др.).
Для получения Р. требуемой прочности растворная смесь должна обладать необходимой подвижностью и водоудерживающей способностью. Степень подвижности растворной смеси устанавливают по глубине погружения в неё стандартного металлического конуса (т. н. конуса СтройЦНИЛ). Водоудерживающая способность характеризуется свойством растворной смеси не расслаиваться при транспортировке и сохранять влажность при укладке (на пористое основание), необходимую для нормального процесса её твердения. С целью экономии цемента при изготовлении т. н. низкомарочных Р. и для придания растворной смеси повышенной пластичности используют ряд приёмов: добавляют к цементу малопрочные, но высокопластичные вяжущие (известь, глину); вводят в растворную смесь тонкомолотые
Добавки (шлаки, золы ТЭС, песок и др.), применяют пластифицирующие поверхностно-активные добавки.
Приготовляют растворные смеси, как правило, на специализированных заводах или растворосмесительных узлах, откуда они поступают на строительные объекты. Выпускаются также сухие растворные смеси, которые перед употреблением смешивают с водой. На строительной площадке растворные смеси транспортируют к месту производства работ
Растворонасосами
. В современном строительстве получают распространение Р. на смеси полимерного и минерального вяжущих (например, поливинилацетатцементные), обладающие высокой прочностью сцепления с основанием, и Р. на полимерных вяжущих (полимеррастворы), отличающиеся высокими химическими стойкостью, прочностью и декоративными качествами. Такие Р. применяют главным образом для устройства покрытий полов в общественных и промышленных зданиях.
Лит.: Строительные нормы и правила, ч. 1, разд. В, гл. 2. Вяжущие материалы неорганические и добавки для бетонов и растворов, М., 1969; Указания по приготовлению и применению строительных растворов, СН 290-64, М., 1965; Воробьев В. А., Комар А. Г., Строительные материалы, М., 1971,
К. Н. Попов.


